
Mikropasaules dzīvokļi
Projekta vadītājs Jānis Liepiņš skaidro, ka mikronodalījums ir viens no baktēriju šūnu ieslēgumu veidiem. Tie sastāv no čaulas proteīniem, kas piešķir mikronodalījumam noteiktu, regulāru formu, kā arī "serdes" enzīmiem, kas realizē noteiktas, baktērijai nepieciešamas reakcijas. Aptuveni 40% no visa pasaules CO2, ko saista fotosintēzes procesā, tiek fiksēts īpašos baktērijās mikronodalījumos – karboksisomās. Mikronodalījumi būtiski uzlabo CO2 saistīšanu, jo ar to palīdzību atsevišķā baktērijas šūnas daļā tiek sakopoti oglekli saistoši enzīmi, un tādējādi lokāli tiek nodrošināti apstākļi maksimāli efektīvai reakcijas norisei. Ja šie paši enzīmi būtu izkliedēti pa visu šūnu, CO2 saistīšana būtu ievērojami lēnāka. Tādējādi pat nelielām baktēriju uzbūves vienībām var būt grandioza ietekme uz pasaules ekosistēmām.
"Mikronodalījumi ir veidojušies evolūcijas procesā kā baktēriju pielāgojumi, kurus baktērijas liek lietā, ja nepieciešams veikt kādu svarīgu procesu, kurā var veidoties gaistoši vai toksiski starpsavienojumi. Mums būtu rūpīgi jāizpēta principi, pēc kādiem darbojas dabā esošie mikronodalījumi, lai pētnieki nākotnē varētu izveidot mākslīgus mikronodalījumus, kas jau realizētu cilvēcei svarīgus procesus. Jau tagad ir veikti izmēģinājumi uzlabot augu oglekļa fiksēšanas efektivitāti, tajos ievietojot baktēriju karboksisomas. Uz mikronodalījumu bāzes izveidotie nanoreaktori varētu ražot farmācijā svarīgus savienojumus vai palīdzēt mikroorganismiem šķelt citādi grūti sašķeļamus substrātus, vai pat radikāli mainīt mikroorganismu barošanās principus, dodot iespēju nefotosintezējošiem organismiem fiksēt CO2," tā nākotnes perspektīvas ieskicē Liepiņš.
Rezultāti, kas paver jaunas iespējas
Uzsākot pētījumu par Klebsiella pneumonia holīna vielmaiņas mikronodalījumu, galvenie uzdevumi bija:
- saprast, vai iespējams šo mikronodalījumu sintezēt citā baktērijā, molekulārajā bioloģijā plaši izmantots organismā – zarnu nūjiņā Escehrichia coli;
- noskaidrot, vai šajā sintētiskajā mikronodalījumā var ievietot tai nosacīti "svešus", citas baktērijas enzīmus;
- pārbaudīt, vai enzīmu darbība sintētiskajā "nanoreaktorā" ir analoga neiepakotiem enzīmiem;
- noskaidrot, vai proteīnu čaula rada būtisku barjeru izejvielu un produktu plūsmai gan no, gan uz sintētiskā mikronodalījuma.
Līdz šim bija zināms, ka gēni, kas kodē holīna vielmaiņas mikronodalījumu daļas – gan čaulu, gan tajā esošos proteīnus – veido vienu gēnu grupu, kas ir kompakti izvietota baktērijas genomā. Tādējādi tiek nodrošināta strauja visu mikronodalījuma komponentu saskaņota sintēze un pašsavākšanās baktērijā. Tomēr līdz šim nebija zināms, vai visi šajā gēnu grupā kodētie proteīni ir vienlīdz svarīgi, lai varētu sintezēt mikronodalījumu citā baktērijā.
Projektā laikā Gints Kalniņš ar citiem BMC pētniekiem ieguva stabilu K. pneumoniae mikronodalījumu ražošanu citā baktērijā – zarnu nūjiņā – un noskaidroja, kāds ir minimālais proteīnu "komplekts", kas ir nepieciešams, lai iegūtu stabilus mikronodalījumus.
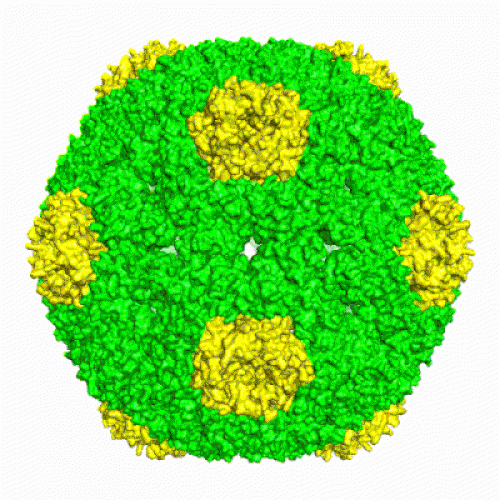
Pirmo reizi pasaulē tika parādīts, pēc kādiem principiem pašsavācas holīna vielmaiņas mikronodalījums. Izrādījās, ka tas notiek secīgi pie galvenā enzīma, holīna liāzes, piesaistoties pārējiem mikronodalījuma komponentiem. Tāpat arī pirmo reizi pasaulē tika noskaidrota šī mikronodalījuma 3D struktūra. Tas izdevās, sadarbojoties ar Centrāleiropas Tehnoloģiju institūta (Masarika Universitāte, Brno, Čehija) speciālistiem. Mikronodalījuma čaulas caurlaidības mērījumi liecināja, ka iegūtais sintētiskais mikronodalījums darbojas efektīvi un tā čaulu var šķērsot salīdzinoši lielas substrāta molekulas.
Projekta ietvaros LU fonda vairākkārtējā stipendiāte, LU Bioloģijas fakultātes absolvente bioloģijas zinātņu maģistre Eva Emīlija Česle izstrādāja maģistra darbu par enzīmu iepakošanas stratēģiju mikrokonodalījumos. Turpmākajos pētījumos nepieciešams pārbaudīt iepakoto enzīmu aktivitāti, kā arī izstrādāt metodi, kas sniedz iespēju vienlaicīgi iepakot vairākus interesējošus enzīmus un tādejādi padarīt dabā sastopamo holīna vielmaiņas mikronodalījumu par platformu jaunu enzīmu iepakošanai cilvēces vajadzībām.
Projekts tapis LU Mikrobioloģijas un biotehnoloģijas institūtā sadarbībā ar Biomedicīnas pētījumu un studiju centru, un īstenots ar mecenāta "Mikrotīkls" finansiālu un LU fonda administratīvu atbalstu.


